(関連目次)→婦人科癌 目次 性感染症と中絶について考える
(投稿:by 僻地の産科医)
 産科と婦人科2008年12月号からですo(^-^)o ..。*♡
産科と婦人科2008年12月号からですo(^-^)o ..。*♡
特集は婦人科がんー最新情報
.
結構おもしろかったです!
この論文はかなりためになりました。
性交未経験の子供世代をもつ親なら、
わが子供に試してみてもいいかな?と思える数字ではあります。
将来的にもうちょっとデータが待ち望まれます。
HPVワクチンの有効性と限界
東京大学医学部産科婦人科
川名 敬 武谷 雄二
(産科と婦人科 第75巻 12号 p1780-1787)
子宮頸がんのほとんどがヒトパピローマウイルス(human papillomavirus : 以下HPV)感染によるウイルス発がんであることは明白となっている.そこでHPVウイルス感染を予防することができれば子宮頸がんを撲滅させることができるのではないか,と期待されている.海外で2000年ぐらいから始まったHPV予防ワクチンの臨床試験の結果がようやく公表され始め,一定の感染予防効果が認められたことから欧米で製剤としてすでに承認されている.これらの予防ワクチンの対象者は,絶対的HPV未感染者である性交未経験者(10歳ぐらい)が最優先となる.これに対して,20歳前後になってすでにHPVに曝されている可能性が否定できない世代に「キャッチアップ接種」を行うことも検討されている.最近になって大規模なキヤッチアップ接種を行った臨床試験の結果が示されてきたので、これを中心にその有用性を論じる.
「キャッチアップ接種 catch-up vaccination」とは、この20歳前後の青年期にワクチンを接種するという接種方法のことで,一般的に行われている小児予防接種の対象疾患において用いられている予防法である.つまり小児期にワクチン接種をし損ねた人、中途半端に終わってしまった人などが、遅ればせながら青年期になってワクチン接種を受けて“catch-up"しよう(追いつこう)というものである.一般の流行感染症では、年齢とともに既感染者が増加していくため,キャッチアップ接種を受ける集団の中にはすでに感染を受けてしまった人が多く含まれてくる.この点が小児期の未感染者を対象とする予防接種とは大きく異なる点である.未感染者を対象とする小児ワクチンにおいてほぼ100%の感染予防効果を発揮するワクチンでも,キャッチアップ接種の場合にワクチン効果がどうなるかは計り知れないところがある.そのインパクトは病原体や対象疾患によってcase by caseである.つま胆キャッチアップ接種の有用性は,そのウイルスの感染・蔓延状況やその感染症の自然史といった疫学情報によって大きく左右される.しかもその疫学情報は、地域によって様相が異なる.HPVワクチンのキャッチアップ接種を考える場合は,HPV感染症とそれに伴う子宮頚部上皮内腫瘍性病変(cervical intraepithelial neoplasia : CIN)の自然史を理解し,日本における疫学情報を念頭におく必要がある.
HPV感染とHPV関連疾患
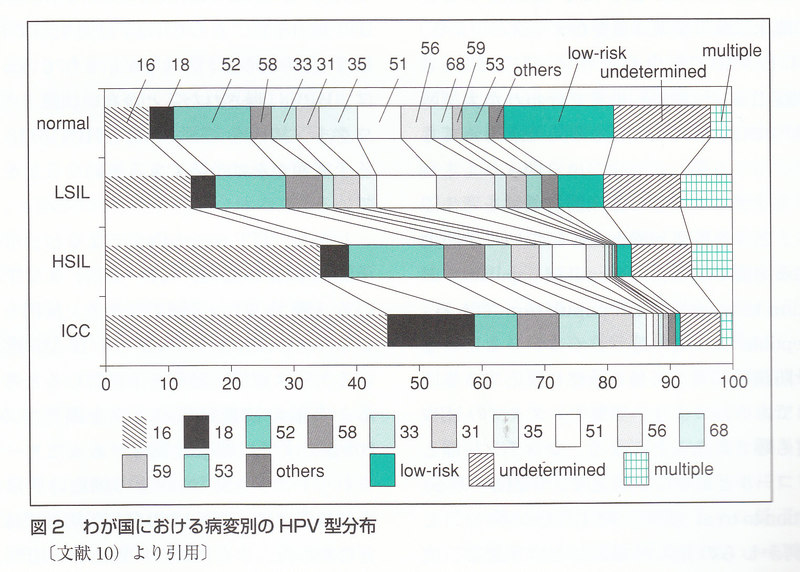
ヒトパピローマウイルス(human papmoma-virus :以下HPV)には現在約100種の遺伝子型(タイプ)が同定されている.そのうち約40種のタイプが子宮頚部,膣壁,外陰,陰茎などに感染する性器HPVである.性器HPVは,子宮頚がんに代表される性器癌から検出される高リスク型HPV(high-risk HPV)と,尖圭コンジローマなどの良性乳頭腫から検出される低リスク型HPV(low-risk HPV)に区別される.区別の仕方は研究者によってばらつきがあるが,おおむね16/18/31/33/35/39/45/51/52/56/58/66/68型が高リスク型,6/11/40/42/43/44/54/61/72が低リスク型と考えられている. このことから,子宮頸がんを完全に撲滅するためには,少なくとも10~15種類のHPVタイプの感染を予防しなければならない.
健常成人女性の生殖器からのHPV-DNAの検出率は、先進国・開発途上国によってばらつきはあるが、20~46%と報告されている.わが国の場合,20歳代妊婦のHPV陽性率が20~30%と報告されている(図1).世界保健機構(WHO)が公表したところによると、全世界でHPVキャリアは年間3億人ずつ増加すると推定されている.また米国では、女性の4人に3人は,一生のうちに少なくとも1回以上のHPV感染を受けるという疫学データがある.すなわちHPV感染はだれでも経験する“common disease”であって,ある特殊な集団だけに起きるイベントではない.そう考えると,性交経験年齢が若年化しているといわれるわが国でも、キャッチアップ接種の世代ではすでに相当数の既感染者が含まれることが予想される.実際、図1に示したようにHPV感染のピークは20代前半であり,10代でもそれに匹敵する頻度である.
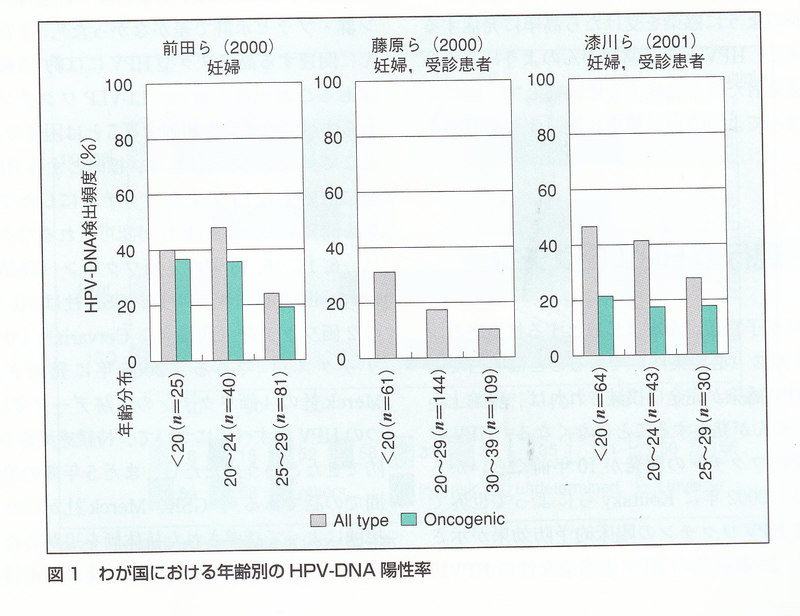
一方,HPV感染者が皆,腫瘍性病変を発症するわけではない.HPV感染台のなかでsquamous intraepitheliaoesion:SILと診断される頻度は10人に1人程度,そのうちhigh-grade SILまで進展するのが10人に1~2人ぐらい,さらにhigh-grade SILから浸潤癌まで進展するのは3人に1人ぐらいといわれている.つまりHPV感染から子宮頸がんにまで進展するのは,200~300人に1人というのが実態である.その結果、わが国におけるHPV関連の腫瘍性疾患の罹患率は、全年齢層10万人に対して,尖形コンジローマで30人(日本性感染症学会のデータ)、子宮頸がんで15人,肛門がんで0.5人(対がん協会のデータ)程度となっている.
キャッチアップ接種を考えるうえで,風疹・はしかのように感染を受けたら高率に発症する感染症と、HPVから子宮顛がんのようにごぐ一部の感染者だけが発症する感染症とで、同じように扱ってよいのかは慎重に検討する必要がある.
現行のHPVワクチン
HPVが子宮頸がんをはじめとする性器癌の原因ウイルス(必要条件)であることは明白である.HPV感染が完全に撲滅されれば,理論上これらのがんが発生することはなくなる.HPVの感染予防ワクチンの開発が10年前ぐらいから始まり.2002年にKoutskyらによって財界で初めてHPVワクチンの臨床的予防効果が示された.20歳前後のHPV未感染女性にHPV16型に対するHPVワクチンを接種し,1年以内にHPV16型持続感染が発生する頻度がプラセボ群で3.8%であったのに対しワクチン群ではO%で,有意にワクチン群の方がHPV16型の持続感染・CINの発症を抑えていることが報告された.それとともに,米国のMerck社と欧州のGlaxo SmithKline (GSK)社が本格的にHPV予防ワクチンの開発に乗り出し,昨年米国と欧州で認可・発売された.この2社のワクチン抗原は,HPV16型L1蛋白質を酵母菌もしくは昆虫細胞で強発現させて,得られるウイルス様粒子virus-like partides (以下VLP)である.外観はウイルス粒子とほぼ同様の立体構造をしているが中身は空で感染性はまったくない(B型肝炎ウイルスのHBs抗原ワクチンと同じ).Koutskyらが報告したワクチンもHPV16 L1-VLPを抗原に用いた.
しかしL1-VLPワクチンの最大の問題は,別のHPVタイプに対する予防効果がほとんどないことである.Koutskyらの検討でも,16型以外のHPVによるCINの発症についてはワクチン群・プラセボ群で差がなかった.子宮頸がんに関連する高リスク型HPVには約15種の型があることを考えると,L1-VLPワクチンでこれらすべての感染を制御するニとは困難である.そこで,GSK,Merck社は,標的とするHPV各型に対応するL1-VLPをカクテルにしたワクチンを開発した.Merck社が認可されるワクチンは,6,11,16,18型の4価ワクチン(商品名:Gardasil〔カーダシル〕),GSK社は16,18型の2価ワクチン(商品名:Cervarix〔サーバリックス〕)である.2006年に発表されたMerck社の4価ワクチンの追跡データでは,4つのHPV型すべてについて,持続感染を96%予防できたという.ただし,まだ5年間の追跡期間での話である.GSK、Merck社がワクチン接種によって誘導された抗体価を追跡したところ,少なくとも4~5年間は抗体価が維持されていた. しかしそれ以上長期的にこの抗体価が維持されるかはまったくわかっていない.GSK社の臨床試験で,16,18型以外のHPV感染の交差予防効果を検討したところ,HPV45型で95%の感染予防効果が得られたが、日本で比較的多いといわれるHPV52,58型に対する予防効果は10%程度であり,16,18,45型以外のHPVタイプには無効であることが再確認された. 両社では、さらにPhase III の臨床試験として,若年者や男性を対象とする群や未感染者に関わらずにランダムに接種する群など、いろいろな試験を行っている.わが国でもこれらの2社主導の治験が始まっている.数年以内にはわが国でも薬品として認可される可能性が高い.
現行のHPVワクチンの問題点
現行のGSK,Merck社のHPVワクチンは,未感染者を対象とし、抗体を誘導することでHPVの感染・蔓延を阻止するためのものである.未感染者を対象として集団予防を行うためにはワクチン対象者を性交未経験と考えられる10歳前後にしなければならない.現時点では,L1-VLPワクチンで誘導された抗体価が維持されることが証明されているのは5年にすぎない.10歳前後で接種した場合に,50歳代の性活動期を超える世代まで感染予防効果を維持できるという保証は今のところない.また、仮に現行のHPVワクチンによる引力効果が終生続くとしても、予防できる子宮頸がんはHPV16,18型によるものだけてあり, 子宮頸がん全体の6~7割にすぎない(図2). したがって現行のワクチンにおいては、「ワクチンを接種すれば子宮頸がんの心配はない、子宮がん検診を受けなくてもよい」とはいいがたい.現行のHPVワクチンを導入するにあたって最も重要なことは,このようなインフォメーションをワクチン接種者に正しく伝える必要があることである.また、現行HPVワクチンは、ウイルスの粒子構造を人工的に作っているため,製造工程が煩雑なうえ、欧米からの輸送費(冷凍輸送)コストがかかるためか,比較的高価なワクチン(1ショット約1万円を越える)といえる.集団接種のためには行政がこの費用を負担することになる.子宮頸がんの減少に伴う医療費の軽減と予防ワクチンに投資する費用を天秤にかけて医療経済的な視点から動向を見据える必要がある.それには,現行のHPVワクチンの予防効果(ワクチン効果)がどの程度であるのかが最大のポイントとなる.今のところ,現行のHPVワクチン接種が始まってまだ5~6年であるため,ワクチンによってどの程度子宮頸がんの発生頻度が減少するかどうかはまだ不明である.
キャッチアップ接種のワクチン効果
――特にITT populationについて
現行のHPVワクチンにおける臨床試験は, 海外で販売されている現在も進行中である.それとともにレベルの高いエビデンスが示されてきた.特に,ランダム化されたキャッチアップ接種の臨床試験の結果は重要なデータといえる.オーストラリアを中心とするFUTURE-I&FUTURE-II studyと北米で行われた大型臨床試験131では,多くの実態が明らかとなってきた.
キャッチアップ接種の臨床的有効性を考える場合に、2つの集団populationについて予防効果を知る必要がある.susceptible population とintention-to-treat(ITT)populationである.“Susceptible ” とは,「感受性がよい」という意で,予防接種に対して最も敏感に反応する集団のことである.つまり,ワクチンタイプのHPVに一度も曝されたことがなく、ワクチン接種もプロトコールどおりに3回完遂した集団である.“lntention-to-treat(ITTと略すことが多い)”とは,「何かしらの介入がある」という意で,実はすでにHPVに感染している.すでに子宮頸部上皮腫瘤性病変がある、1~2回しか接種を受けず不完全な接種である,ワクチンでカバーできない型のHPVでCINが発生した、といったマイナス要素があるためにワクチン効果が落ちることが予想される集団である.公衆衛生学的には、後者のITTがワクチンの実態を反映しており,信憑性の高いデータであると考えられている.
そこで、上述したHPVワクチンでキャッチアップ接種を行った大型臨床試験の結果をsusceptible population とHT population に分けて表1に示した.これらの臨床試験では,16~25歳の女性を対象として,ワクチン接種前に事前に子宮頸部細胞診,HPV-DNA検査,HPV抗体検査を調べている.その結果を伏せておき.ワクチン群とプラセボ群にランダムに分けて接種プロトコールを遂行している.プロトコール終了後2~3年の追跡を行った後,CIN2-3の発症の有無をend pointに置いて,その予防効果を画群で比較している.susceptible populationでは、どちらの試験でもワクチン群ではHPV16/18型によるCIN2-3は発生しておらず,ぼぼ100%の発症利益効果が示されている.これは、HPVに曝されたことがない状態できちんとワクチン接種を完遂すれば,HPV16/18型による子宮頸がんば予防できるということを示唆している.
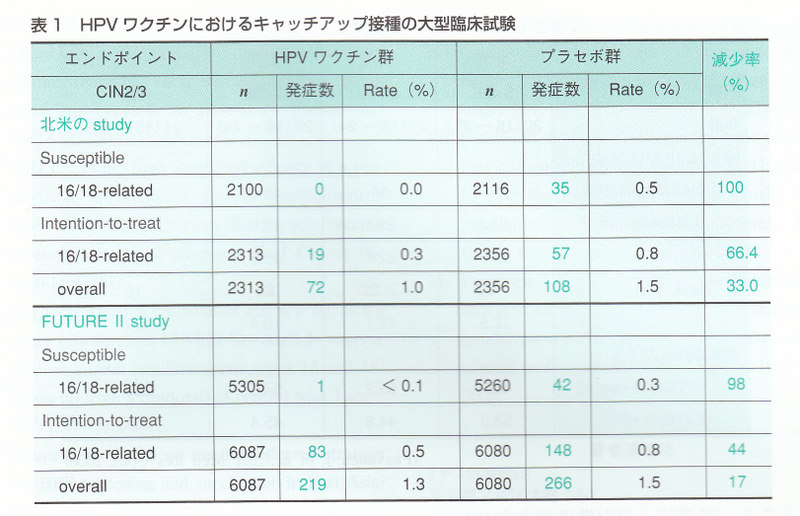
しかし、ITT population になると、その発症予防効果は50%前後(44~66%)まで下がっている(表1).1~2回でワクチン接種を止めてしまうケースやすでにHPV16/18型に感染しているケースが予防効果を下げていると考えられる.事前の検査結果のフタを開けてみると,10%強ですでに細胞診異常があったケースが含まれていた.ASCUS以上の細胞診異常があった対象者では、CIN2-3の発症予防効果はほとんどなかった.また,16/18型以外のHPVによるCIN2-3もend pointに含めると,その発症予防効果は17~33%まで下がる(麦1).これは,現行のHPVワクチンは、16/18型以外のHPV感染に対する交差予防効果がぼとんどないために,ワクチン接種してもHPV16/18型以外のHPVによるCIN2-3を食い止めることができず,プラセボ群との差が縮んでいることを示唆している.図2で示したように,わが国ではHPV16/18型によるCIN2-3は全休の40%程度である.HPV16/18型によるCIN2-3発症をキャッチアップ接種によって50%減少させたとしても,CIN2-3の罹患者数は全体の20%しか減少しないということになる.
それではキャッチアップ接種の世代(16~25歳)では、どのぐらいの対象者がすでにHPVに感染していたのか.世界各地域におけるキャッチアップ接種の大型臨床試験の際に,事的にどの程度の感染者が存在していたのかを示したデータがある. 表2に示すように欧米では、おおむね30%前後の女性がすでにキャッチアップ接種の事前にHPV16/18/6/11型のいずれかに既感染である.したがって,約30%の女性には,キャッチアップ接種を行っても,ワクチン効果は期待できない.逆に,約70%の女性にとっては,キヤッチアップ接種を完遂することによってCIN2-3や尖圭コンジローマの発症を予防できる.繰り返しになるが,ここでいう発症予防はあくまでもHPV16/18型によるCIN2-3の発症予防である.アジア・オセアニアは、これらのワクチンタイプのHPV感染が15%と,ほかと比べて少ない傾向がある.同時に示された細胞診異常者の内訳で16/18/6/11型が欧米よりも明らかに少ない(図2で示したわが国のデータと類似)ことを考えると,アジア・オセアニアでは16/18型はワクチンによって予防できても,HPV16/18型以外のCIN患者が多いために,結局ワクチン効果としてのインパクトはあまり変わらないと考えられる.
さらに,表2でもわかるように,26歳以上でのキャッチアップ接種のデータはいまだに存在しない.これは,26歳以上になると相当数の有病者や既感染者が含まれてくるうえに、ワクチンに対する免疫応答も年齢とともに低下するために臨床研究として成立していないからである.今のところ、26歳以上の女性に対するHPVワクチン接種については、海外を含めハイレベルのエビデンスはない.
おわりに
海外の大型臨床試験のデータによって,現行のHPVワクチンを用いたキャッチアップ接種の有効性と限界が示されたことは大きな前進である.現行のHPVワクチンを公費負担にして集団予防した方が,予防せずに発症する子宮頸がんの医療費負担よりも医療経済的なコストパフォーマンスがよいという算定もあるようだが,キャッチアップ接種のITT population で示されたように,予防ワクチンの有効性の推定はそう簡単ではなさそうである.仮に絶対的末感染者である性交未経験世代を対象としてもワクチン接種が不完全だとワクチン効果は低下するだろう.しかも,これまでのデータはいずれも追跡期間が6年程度しかなく長期的な有効性はまったくわからない.したがって安易に公費負担とか集団予防の義務化に踏み込むべきではない.わが国に限らないことであるが,HPVワクチンの活用法については慎重に検討していく必要がある.

コメント